研究内容
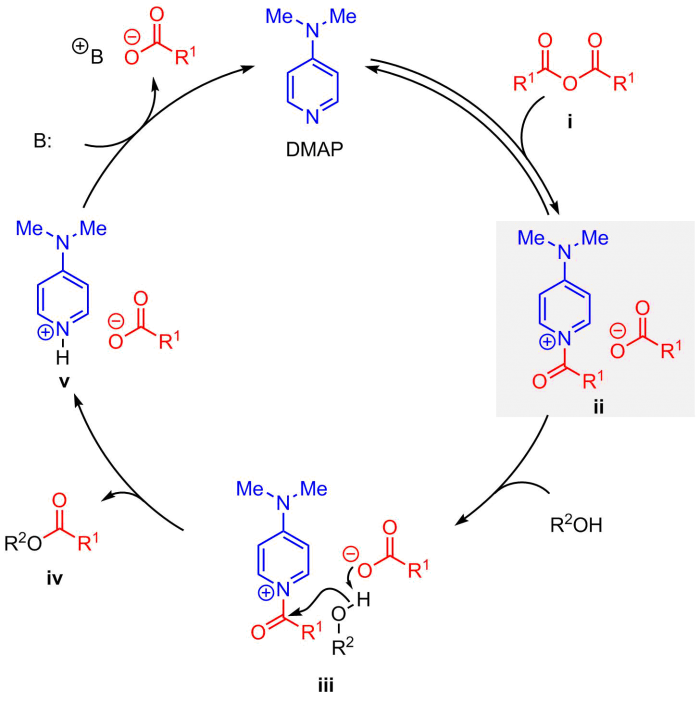
N,N-4-ジメチルアミノピリジン(DMAP)は,アルコールのアシル化反応を効率的に促進できる触媒として,合成反応によく利用される求核触媒の一つである1.この反応のメカニズムは,一般的に図1のように理解されている.この反応で光学活性体のDMAPを用いると,原理的にはアルコールの速度論的光学分割反応となり,未反応の反応基質は光学活性なアルコールとなる.しかし一般的に光学活性DMAP誘導体の合成ルートが長く煩雑であり,またこれとは別の問題としてDMAPに不斉源を導入すると,N-アシルピリジニウム塩 ii の生成が遅くなるうえ,反応中間体 iii においてDMAP上の不斉源と求核剤(R2OH)との立体反発により,劇的な反応速度低下を招いてしまう問題があった2.そこで我々は,これらの難しい課題に対して,(1)光学活性DMAPの迅速合成および(2)求核触媒反応の反応加速の2点をキーワードとして,独自のアプローチでこの問題に取り組んだ.
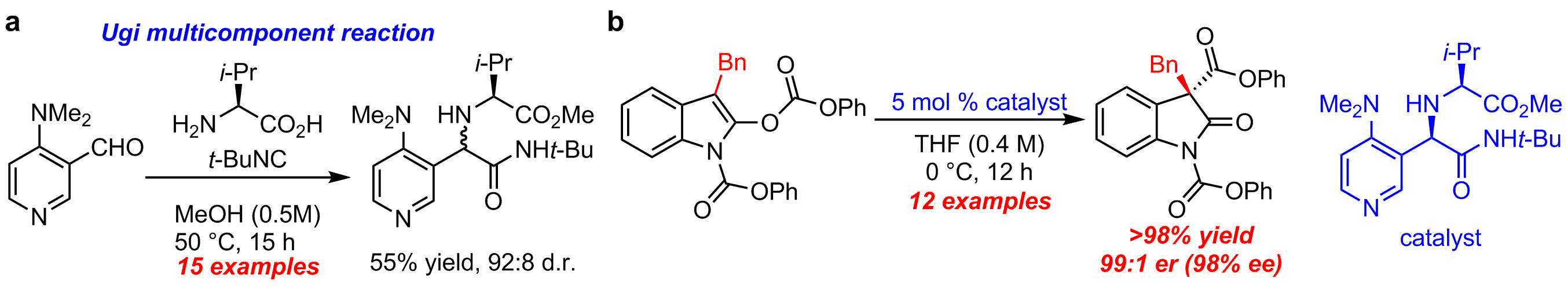
多成分連結反応を活用する光学活性DMAPのワンポット一工程合成
我々は光学活性DMAPの迅速合成を目指し,多成分連結反応として知られるUgi反応を利用して構造多様性に富んだ光学活性DMAPをワンポット一工程で一挙に合成することに成功した(図2a)3.このUgi生成物を求核触媒として用いると第二級アルコールの光学分割反応4やオキシインドール類の不斉Steglich反応5(図2b)などが効率的に進行することを明らかにした.
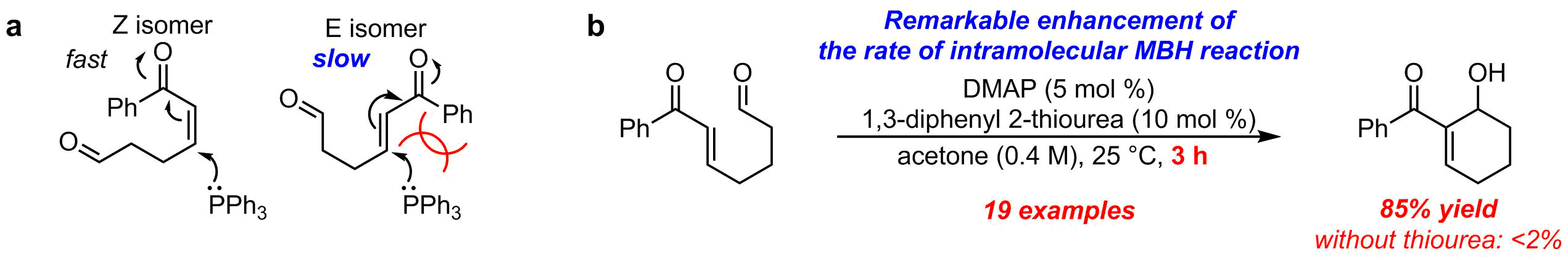
求核触媒と共触媒の相乗効果による分子内Morita-Baylis-Hillman反応の高速化
分子内Morita-Baylis-Hillman (MBH) 反応は,高度に官能基化された環状化合物に変換できることから,合成化学的価値の高い反応として知られている.しかし反応基質のa,b-不飽和ケトン部位のE/Z異性体が反応速度に大きな影響を与え,E体を用いると反応速度が劇的に低下することが報告されている(図3a)6.特にDMAPは分子内MBH反応を促進するほど求核性は高くないため,その報告例はこれまで全くなかった.我々の光学活性DMAPを用いて本反応を行うためには,求核触媒の低減と反応の加速化を両立する必要がある.そこでアキラルなDMAPを用いて検討を重ねた結果,ごくわずかの触媒量のDMAP(5 mol %)とジフェニルチオウレア(共触媒:10 mol %)を同時に用いると,反応が劇的に加速され,わずか反応時間3時間で生成物が得られることを明らかにした(図3b)7.この反応は求核触媒または共触媒のどちらかが欠けると全く反応は進行しない.このように極めて効率的な反応系を開発することができたので,現在我々の開発した光学活性DMAPを用いて不斉分子内MBH反応へと展開しているところである.
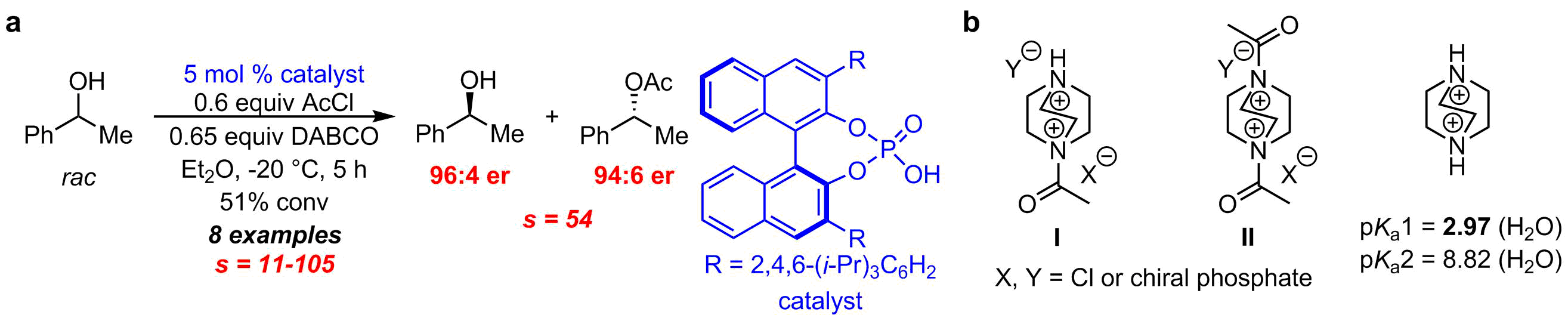
キラルリン酸の反応加速効果による第二級アルコールの速度論的光学分割反応
我々は光学活性DMAPの創出のみならず,N-アシルピリジニウム塩 ii(図1,前頁)の対アニオンをキラルリン酸などで効果的に活性化できれば,エナンチオ選択的なアシル化反応が行えるものと考え,新しい反応系を模索した.その結果,DMAPの代わりに1,4-ジアザビシクロ[2.2.2]オクタン(DABCO)を用い,これにキラルリン酸を作用させると第二級アルコールの速度論的光学分割反応が劇的に促進されることを見いだした(図4a)8.各種検証実験から系中で発生するジカチオン種IあるいはIIが極めて反応性の高い反応活性種として反応に関与していると推測される(図4b).これはDABCOジカチオン種のうち第一解離の値(pKa1 = 2.97)が非常に大きいことから説明できる.本反応はキラルリン酸を用いるアシル化による第二級アルコールの速度論的光学分割反応の初めての報告である.
劇的な反応加速効果と高エナンチオ選択性をもたらす光学活性DMAPの開発
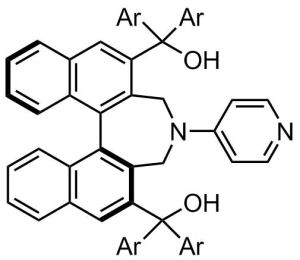
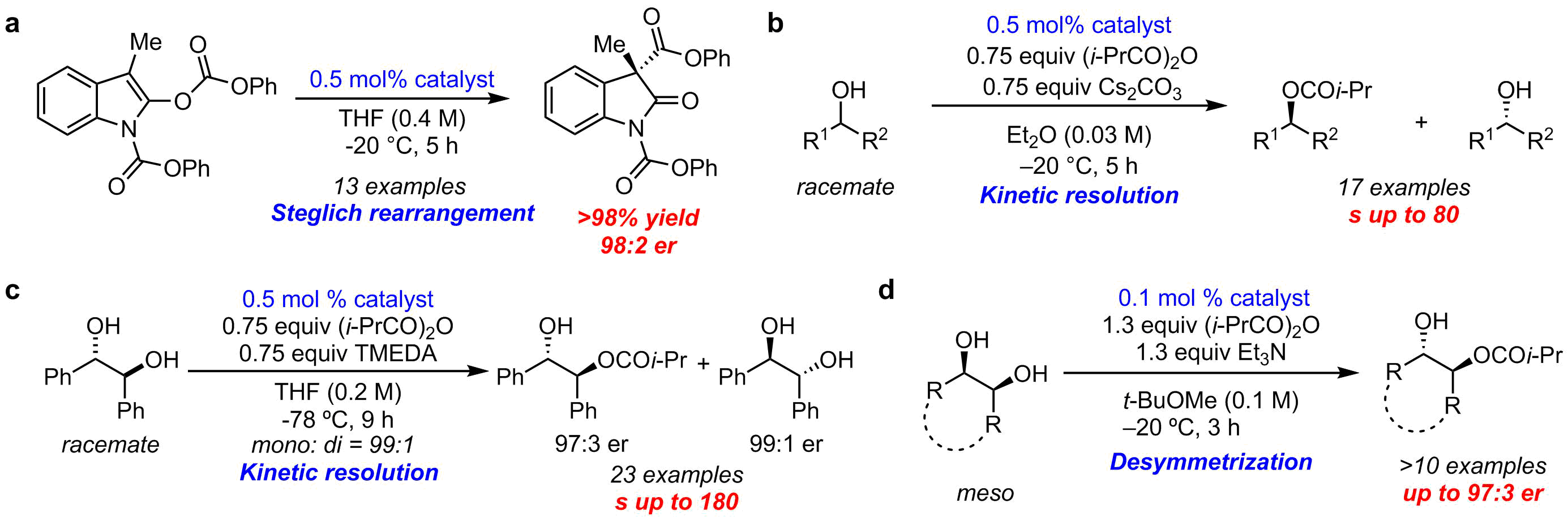
我々は入手容易な(S)-1,1′-ビ-2-ナフトール[(S)-BINOL]を不斉源として,新規光学活性DMAPを設計・合成した(図5).この触媒は最終段階で様々な置換基(Ar=種々の芳香族)を導入できるため,構造多様性に富んだ触媒の迅速供給が可能となった.本触媒をごく少量 (0.5–5.0 mol %) 用いると不斉Steglich反応(図6a),カルビノール(図6b)9やd,l-1,2-ジオールの速度論的光学分割反応(図6c),meso-1,2-ジオールの非対称化反応(図6d)など多様な反応を著しく加速するだけでなく,非常に高いエナンチオ選択性が発現することを明らかにした10.さらに,この劇的な反応加速効果と高エナンチオ選択性の要因は,触媒の水素結合性置換基[-C(OH)Ar2]と反応基質の間に働く水素結合が鍵となっていることを突き止めた.本触媒は既知の光学活性DMAPを凌駕する触媒活性と高エナンチオ選択性を獲得した.さらに本触媒は東京化成工業株式会社より既に販売されており,様々な応用研究に容易に用いることができるため,医薬品や農薬などのファインケミカルの分野で応用研究が進展することが期待される.
新規分子標的薬の創製を志向した生理活性物質の合成ならびに癌・炎症性疾患領域における検討
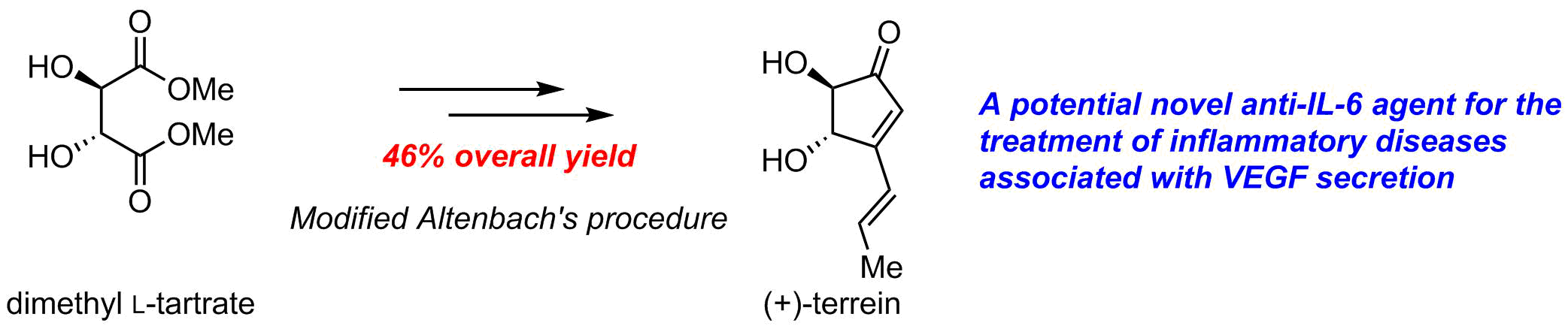
既存の血管から新たな血管が出芽して血管網が再構築される過程を血管新生と呼ぶ.これを阻害してやれば「血流遮断による兵糧攻め」によって口腔癌および歯周炎の進行を抑えることができると考えられる.そこで我々は真菌が生産する低分子化合物である(+)-terreinに着目した.文献法を参考に効率的な合成法を確立し,総収率46%(文献収率26%)で(+)-terreinを合成することができた(図7).また合成品の(+)-terreinは炎症性疾患領域11および癌領域12おいて極めて有効であることを明らかにした.さらにマイクロフロー法による合成にも挑戦しているところである。
参考文献
- Steglich, W.; Höfle, G. Angew. Chem. Int. Ed. 1969, 8, 981.
- Wurz, R. P. Chem. Rev. 2007, 107, 5570.
- Mandai, H.; Irie, S.; Mitsudo, K.; Suga, S. Molecules 2011, 16, 8815.
- Mandai, H.; Irie, S.; Akehi, M.; Yuri, K.; Yoden, M.; Mitsudo, K.; Suga, S. Heterocycles 2013, 87, 329.
- Mandai, H.; Fujiwara, T.; Noda, K.; Fujii, K.; Mitsudo, K.; Korenaga, T.; Suga, S. Org. Lett. 2015, 17, 4436.
- Teng, W.-D.; Huang, R.; Kwong, C. K.-W.; Shi, M.; Toy, P. H. J. Org. Chem. 2005, 71, 368.
- Mandai, H.; Shimowaki, K.; Mitsudo, K.; Suga, S. Asian J. Org. Chem. 2014, 3, 437.
- Mandai, H.; Murota, K.; Mitsudo, K.; Suga, S. Org. Lett. 2012, 14, 3486.
- Fujii, K.; Mitsudo, K.; Mandai, H.; Suga, S. Bull. Chem. Soc. Jpn. 2016, 89, 1081.
- Mandai, H.; Fujii, K.; Yasuhara, H.; Abe, K.; Mitsudo, K.; Korenaga, T.; Suga, S. Nat. Commun. 2016, 7, 11297.
- Mandai, H.; Omori, K.; Yamamoto, D.; Tsumura, T.; Murota, K.; Yamamoto, S.; Mitsudo, K.; Ibaragi, S.; Sasaki, A.; Maeda, H.; Takashiba, S.; Suga, S. Bioorg. Med. Chem. 2014, 22, 5338.
- Shibata, A.; Ibaragi, S.; Mandai, H.; Tsumura, T.; Kishimoto, K.; Okui, T.; Hassan, N. M. M.; Shimo, T.; Omori, K.; Hu, G.-F.; Takashiba, S.; Suga, S.; Sasaki, A. Anticancer Res. 2016, 36, 2161.
